高解析度熔解
此條目需要補充更多來源。 (2022年12月23日) |
高解析度熔解(英語:High Resolution Melt,縮寫:HRM) 分析是分子生物學中的一項強大的技術。這項技術是用於檢測雙鏈DNA樣本中的突變、多態性和表觀遺傳差異。它是由愛達荷科技公司和猶他大學發現並開發的[1]。與其他基因型分型技術相比,它具有以下優勢:
- 與其他基因分型技術(如DNA測序和TaqMan SNP基因分型)相比,它更具有成本效益。這使它成為大規模基因分型項目的理想選擇。
- 它不僅快而且強大,因此它能夠快速並準確地對許多樣本進行基因分型。
- 使用起來非常簡單。 通過高質量的HRM檢測,非遺傳學家可以在任何實驗室使用具有HRM功能的實時PCR機器進行強大的基因分型。
方法
[編輯]HRM分析是在雙鏈DNA樣本上進行的。通常,使用者會在HRM分析之前使用聚合酶鏈式反應(PCR)來擴增他們感興趣的突變所在的DNA區域。這個被擴增的區域被稱為擴增子。在PCR過程之後,HRM分析開始。HRM過程只是將擴增子的DNA從50˚C左右精確升溫到95˚C左右。在這個過程中的某個時刻,溫度會達到擴增子的熔點溫度,擴增子的兩條DNA鏈會分離。
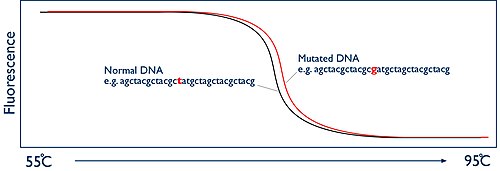
HRM的關鍵是實時監測DNA鏈的分離。這可以通過使用螢光染料實現的。用於HRM的染料被稱為插層染料,並且具有獨特的特性。插層染料專門與雙鏈DNA結合,當它們結合時會發出明亮的螢光。在沒有雙鏈DNA的情況下,染料沒有任何東西可供結合,因此只能發出低水平的螢光。在HRM分析開始時,由於擴增子有數十億個拷貝,樣品中會發出高水平的螢光。但隨著樣品被加熱,DNA鏈分離,雙鏈DNA的存在不斷減少,導致螢光減弱。HRM機器有一個攝像頭,通過測量螢光來觀察這個過程。然後機器將這一數據簡單地繪製成一個被稱為熔解曲線的圖形,顯示螢光水平與溫度的關係。
熔解曲線的比較
[編輯]兩條DNA鏈分開時擴增子的溫度是完全可以預測的。它取決於DNA鹼基的序列。如果比較來自兩個不同人的兩個樣本,他們應該會給出完全相同形狀的熔解曲線。然而,如果其中一人擴增的DNA區域有突變,那麼這將改變DNA鏈溶解的溫度。這會導致兩條熔解曲線結果不同。雖然這種差異可能非常微小,也許是零點幾度,但是由於HRM機器有能力以「高解析度」監測這一過程,因此可以準確記錄這些變化,從而確定是否存在突變。
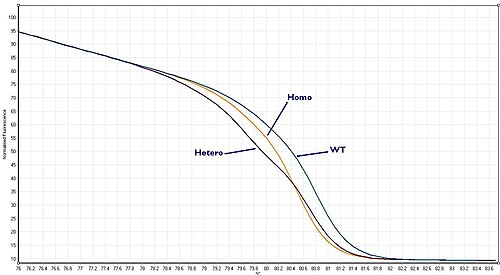
野生型、雜合子和純合子
[編輯]生物體擁有每個基因的兩個(或更多)拷貝,被稱為兩個等位基因。因此,如果從患者身上採集樣本並使用PCR進行擴增,則關注的DNA(等位基因)區域的兩個拷貝都會被擴增。如果想尋找突變,有三種可能性:
這三種情況分別被稱為「野生型」、「雜合子」和「同合子」。每一種都會給出了一個略有不同的熔解曲線。有了高質量的HRM檢測,就可以區分這三種情況。
純合子等位基因變體的特徵可以是HRM分析所生成的熔解曲線上的溫度偏移。相比之下,雜合子的特徵在於熔解曲線形狀的變化。這是由於野生型和變異鏈之間不穩定的異源雙鏈退火產生的鹼基對不匹配。 在生成的熔解曲線上可以很清楚地看到這些差異,並且可以通過生成差異曲線直觀地放大不同基因型之間的熔解曲線差異。[2]
應用
[編輯]SNP基因分型/點突變檢測
[編輯]傳統的SNP基因分型方法通常既費時又昂貴,需要將多個基於探針的檢測方法多重組合在一起或使用DNA微陣列。HRM更具成本效益,減少了設計多對引物和購買昂貴探針的需要。HRM方法已經成功地用於檢測電壓敏感鈉通道(Vssc)基因中的一個G到A的替換,該基因賦予疥蟎對殺蟎劑百滅寧的抗性。這種突變導致蛋白質的編碼(G1535D)發生變化。通過HRM對從疑似百滅寧易感和耐受人群中收集的疥蟎進行的分析顯示出不同的熔解曲線。據觀察,對蟎蟲敏感的擴增子相對於對蟎蟲耐受具有更高的熔解溫度,這是由於GC鹼基對的熱穩定性更高。[3]
在與臨床診斷相關的領域中,HRM已被證明原則上適用於檢測乳腺癌易感基因BRCA1和BRCA2的突變。在這些基因中已鑑定出了400多個突變。基因測序是識別突變的黃金標準。然而,測序既費時又費力,而且測序之前通常有用於識別異源雙鏈DNA的技術,然後進一步放大這些問題。HRM提供了一種更快、更方便的閉管方法來分析突變的存在,並提供了一個結果,如果有興趣,還可以進行進一步研究。在2006年由Scott等人進行的一項研究中[4],使用了3個帶有不同BRCA突變的細胞系來評估HRM方法。研究發現,所產生的PCR產物的熔解曲線可以用來區分擴增子中是否存在突變。同樣,在2007年,Krypuy等人表明[5],精心設計的HRM檢測(關於引物放置)可以成功地用於檢測TP53基因的突變,該基因編碼乳腺癌和卵巢癌臨床樣本中的腫瘤抑制蛋白p53。這兩項研究都強調了一個事實,即熔解曲線的變化可能是熔解溫度的變化或熔解曲線形狀的明顯差異。這兩個參數都是擴增子序列的函數。科學家一致認為,HRM是一種具有成本效益的方法,可用作懷疑含有多態性或突變的樣本的初始篩選。這將減少需要使用更傳統方法進一步研究的樣本數量。
接合性測試
[編輯]目前有許多方法可用於確定基因在特定位點的接合性狀態。這些方法包括使用專門設計的探針進行PCR,以檢測基因的變異(SNP基因分型是最簡單的情況)。如果涉及較長的變異範圍,可能需要對擴增子進行PCR後分析。可以測量限制酶、電泳和色譜圖譜的變化。由於需要在PCR後的實驗室中處理高濃度的擴增子,這些方法通常更耗時,並且會增加實驗室中擴增子污染的風險。HRM的使用減少了分析所需的時間和污染的風險。HRM是一個更具成本效益的解決方案,高解析度元件不僅可以確定同源性和雜合性,還可以解析有關同源性和雜合性類型的信息,不同的基因比變異會產生不同的熔體曲線形狀。Gundry等人於2003年的一項研究表明[6],對引物(一對)進行螢光標籤比使用插層染料(如SYBR綠色I)更有利。然而,在開發和使用改進的插層染料方面已經取得了進展[7],它減少了PCR抑制的問題和對染料非飽和插層的擔憂。
表觀遺傳學
[編輯]HRM方法也被用於提供DNA甲基化狀態的可靠分析。這非常重要,因為腫瘤抑制基因、調節細胞的凋亡和DNA修復的甲基化狀態的變化是癌症的特徵,而且這對化療的反應也有影響。例如,如果患者的DNA修復基因MGMT的啟動子被甲基化,癌症患者可能對DNA烷化劑治療更敏感。在一項測試MGMT啟動子在19個結直腸樣本上的甲基化狀態的研究中,發現有8個樣本被甲基化。[8]另一項研究則比較了通過亞硫酸鹽定序、焦磷酸測序和HRM獲得的83名高級別神經膠質瘤患者中MGMT啟動子甲基化的預測能力。發現HRM方法在量化甲基化水平方面至少等同於焦磷酸測序。[9]
甲基化的DNA可以通過亞硫酸氫鹽修飾進行處理,將非甲基化的胞嘧啶轉化為尿嘧啶。因此,最初未甲基化的模板產生的PCR產物的熔點會低於甲基化模板產生的PCR產物。HRM還提供了確定特定樣品中甲基化比例的可能性,方法是將其與標準曲線進行比較,標準曲線是由不同比例的甲基化和非甲基化的DNA混合而成的。這可以提供關於腫瘤可能具有的甲基化程度的信息,從而表明腫瘤的特徵以及它偏離「正常」的程度。
HRM實際上也有利於診斷,因為它能夠適應高通量篩選(HTS)測試,並且由於其閉管形式,它可以將擴增子在實驗室內擴散和污染的可能性降到最低。
插層染料
[編輯]為了跟蹤雙鏈DNA到單鏈DNA的轉變,採用了插層染料。這些染料顯示出不同的螢光發射,這取決於它們與雙鏈或單鏈DNA的結合。SYBR綠色I是第一代用於HRM的染料。當它嵌入到雙鏈DNA而不是單鏈DNA中時,它會發出螢光。它只能在亞飽和濃度下使用,因為它在高濃度時可能會抑制PCR。最近,一些研究人員不鼓勵將SYBR綠色I用於HRM[10],並聲稱需要對協議進行大量修改。這是因為有人認為,缺乏準確性可能是由於「染料跳躍」造成的,即融化的雙鏈體的染料可能被重新摻入到尚未融化的雙鏈DNA區域中。[6][10]LC Green和LC Green Plus、ResoLight、EvaGreen、Chromofy及SYTO 9等新型飽和染料已上市並已成功用於HRM。然而,一些人已經成功地將SYBR綠I與Corbett Rotorgene儀器[11]一起用於HRM,並提倡將SYBR綠I用於HRM的應用。
高解析度熔解實驗的設計
[編輯]高解析度熔解分析通常涉及qPCR擴增,然後用螢光染料收集熔解曲線。由於高解析度熔解分析的敏感性,需要仔細考慮PCR循環條件、模板DNA的質量和熔解曲線的參數。[12]為了獲得準確且可重複的結果,必須優化PCR熱循環條件,以確保所需的DNA區域以高特異性和序列變體之間的最小偏差被擴增。熔解曲線通常在很寬的溫度範圍內進行,以小的(~0.3℃)增量進行,並需要足夠長的時間(~10秒)以使DNA在每個溫度步驟達到平衡。
除了典型的引物設計考慮因素外,用於高解析度熔解分析的引物設計還涉及最大化屬於不同基因型的PCR產物之間的熱力學差異。較小的擴增子通常比較長的擴增子產生更大的解鏈溫度變化,但這種變化無法用眼睛來預測。因此,在設計可區分序列變異的引物時,準確預測PCR產物的熔解曲線至關重要。專業軟體,如uMelt[13]和DECIPHER[14],可以幫助設計引物,使熔解曲線的變異性最大化,專門用於高解析度的熔解測定。
參見
[編輯]參考文獻
[編輯]- ^ For academic treatment of the history of HRM see http://www.dna.utah.edu/Hi-Res/TOP_Hi-Res%20Melting.html (頁面存檔備份,存於網際網路檔案館)
- ^ S Taylor et al., 2010. A Practical Guide To High Resolution Melt Analysis Genotyping. BioRad Tech Note 6004.
- ^ Pasay C, Arlian L, Morgan M, et al. High-resolution melt analysis for the detection of a mutation associated with permethrin resistance in a population of scabies mites. Med. Vet. Entomol. March 2008, 22 (1): 82–8. PMID 18380658. S2CID 41493770. doi:10.1111/j.1365-2915.2008.00716.x.
- ^ James PA, Doherty R, Harris M, et al. Optimal selection of individuals for BRCA mutation testing: a comparison of available methods. J. Clin. Oncol. February 2006, 24 (4): 707–15 [2022-12-25]. PMID 16446345. doi:10.1200/JCO.2005.01.9737. (原始內容存檔於2008-07-04).
- ^ Krypuy M, Ahmed AA, Etemadmoghadam D, et al. High resolution melting for mutation scanning of TP53 exons 5-8. BMC Cancer. 2007, 7: 168. PMC 2025602
 . PMID 17764544. doi:10.1186/1471-2407-7-168.
. PMID 17764544. doi:10.1186/1471-2407-7-168.
- ^ 6.0 6.1 Gundry CN, Vandersteen JG, Reed GH, Pryor RJ, Chen J, Wittwer CT. Amplicon melting analysis with labeled primers: a closed-tube method for differentiating homozygotes and heterozygotes. Clin. Chem. March 2003, 49 (3): 396–406. PMID 12600951. doi:10.1373/49.3.396
 .
.
- ^ Wittwer CT, Reed GH, Gundry CN, Vandersteen JG, Pryor RJ. High-resolution genotyping by amplicon melting analysis using LCGreen. Clin. Chem. June 2003, 49 (6 Pt 1): 853–60. PMID 12765979. doi:10.1373/49.6.853
 .
.
- ^ Wojdacz TK, Dobrovic A. Methylation-sensitive high resolution melting (MS-HRM): a new approach for sensitive and high-throughput assessment of methylation. Nucleic Acids Res. 2007, 35 (6): e41. PMC 1874596
 . PMID 17289753. doi:10.1093/nar/gkm013.
. PMID 17289753. doi:10.1093/nar/gkm013.
- ^ Switzeny, Olivier J.; Christmann, Markus; Renovanz, Mirjam; Giese, Alf; Sommer, Clemens; Kaina, Bernd. MGMT promoter methylation determined by HRM in comparison to MSP and pyrosequencing for predicting high-grade glioma response. Clinical Epigenetics. 2016-05-05, 8: 49. ISSN 1868-7083. PMC 4858829
 . PMID 27158275. doi:10.1186/s13148-016-0204-7.
. PMID 27158275. doi:10.1186/s13148-016-0204-7.
- ^ 10.0 10.1 Reed GH, Kent JO, Wittwer CT. High-resolution DNA melting analysis for simple and efficient molecular diagnostics. Pharmacogenomics. June 2007, 8 (6): 597–608. PMID 17559349. doi:10.2217/14622416.8.6.597. as PDF (頁面存檔備份,存於網際網路檔案館)
- ^ Pornprasert S, Phusua A, Suanta S, Saetung R, Sanguansermsri T. Detection of alpha-thalassemia-1 Southeast Asian type using real-time gap-PCR with SYBR Green1 and high resolution melting analysis. Eur. J. Haematol. June 2008, 80 (6): 510–4. CiteSeerX 10.1.1.509.2403
 . PMID 18284625. S2CID 20502526. doi:10.1111/j.1600-0609.2008.01055.x.
. PMID 18284625. S2CID 20502526. doi:10.1111/j.1600-0609.2008.01055.x.
- ^ Montgomery JL, Sanford LN, Wittwer CT. High-resolution DNA melting analysis in clinical research and diagnostics.. Expert Rev Mol Diagn. 2010, 10 (2): 219–240. PMID 20214540. S2CID 22170964. doi:10.1586/erm.09.84.
- ^ Dwight Z, Palais R, Wittwer CT. uMELT: prediction of high-resolution melting curves and dynamic melting profiles of PCR products in a rich web application.. Bioinformatics. 2011, 27 (7): 1019–1020. PMID 21300699. doi:10.1093/bioinformatics/btr065
 .
.
- ^ Wright ES, Vetsigian KH. DesignSignatures: a tool for designing primers that yields amplicons with distinct signatures.. Bioinformatics. 2016, 32 (10): 1565–1567. PMID 26803162. doi:10.1093/bioinformatics/btw047
 .
.